ما هي التراكيب الأربعة للبروتين protein structures
ما هي التراكيب الأربعة للبروتين ؟ protein structures
ترجمة : مريم بكر عبد الحكيم
مراجعة وتدقيق : محمد ياسر الصدفي
تعتبر البروتينات هي الجزيئات العاملة في الخلية ولذلك يتطلب معرفة بنيتها وشكلها الفراغي؛حيث أن معرفة البنية
الفراغيه للبروتين هي التي تحدد وظيفته.
* بنية البروتين:
-هناك العديد من اشكال بنية البروتين مثل: الاولي ، او الثانوي، او الثلاثي او الرباعي. او علي حسب الشكل الفراغي لكل بنية منهم
.
يمكننا أن نبدأ الحديث في هذا الموضوع عن طريق عرض سؤال مبسط يوضح هيكلة البروتين، وهو ما السبب وراء تغير حالة بياض البيض من الحالة الشفافة الي حالة التخثر عند تعرضه للحرارة؟!
_ حيث يحتوي بياض البيض علي كميات كبيرة من البروتينات تسمي بالألبومين وعادة ما يكون للألبومين شكل ثلاثي الأبعاد وهذا يرجع الي الروابط الموجودة بين الاحماض الامينية المختلفة في البروتين.
فيؤدي التسخين الي كسرهذه الروابط واظهار الاحماض الامينية التي تكره الماء والتي عادة ما تكون داخل البروتين هاربة من الماء، فتلتصق هذه الاحماض الامينية ببعضها البعض لتشكل شبكة بروتينية والتي تعطي هذه البنية لشكل بياض البيض وتجعلنا ننعم بإفطار هنئ .
-وعلي اثرهذا فإن شكل البروتين مهم جدا لوظيفته ولفهم كيف يحصل البروتين علي شكله النهائي أو كيفية تكوينه ،فنحتاج لفهم البنية المختلفة لتركيبه (الاولي والثانوي والثلاثي والرباعي)
*البنية الاولية للبروتين:
-فهي تعتبر ابسط مستوي لبنية البروتين وهي عبارة عن تسلسل من الاحماض الامينية في سلسلة عديد الببتيد .
-يتم تحديد تسلسل البروتين عن طريق الحمض النووي للجين الذي يشفر البروتين او اجزاء منه وقد يؤدي التغيير في تسلسل الحمض النووي للجين الي تغيير في تسلسل الحمض الاميني للبروتين. فلو تغير حمض اميني واحد فقط في تسلسل البروتين يمكن ان يؤثر علي بنية البروتين ووظيفته بشكل عام .
علي سبيل المثال ما يحدث اثر المرض المورث ( خلايا الدم المنجيلية) ، فعند حدوث تغير في الاحماض الامينية لخلايا الدم الحمراء ينتج عنه فقر الدم المنجيلي.
فانه يحدث تغير طفيف في التسلسل الذي يتكون من سلاسل البولي ببتيد التي يتكون منها الهيموجلوبين وهو البروتين الذي يحمل الاكسجين في الدم .
حيث يتم استبدال حمض الجلوتاميك الذي يكون عادة الحمض الاميني السادس لسلسلة بيتا (وهو احد النوعين من سلاسل البروتين التي يتكون منها الهيموجلوبين).
-ويتضح الفرق بين الهيموجلوبين الطبيعي وبروتين هيموجلوبين الخلية المنجلية،هو ان جزئ الهيموجلوبين يتكون من سلسلتين الفا وسلسلتين بيتا ويتكون كل منها من حوالي 150 من الاحماض الامينية . حيث مجموعه يصل الي 600 من الاحماض الامينية في البروتين بأكمله، اي ان الفرق بين جزئ الهيموجلوبين الطبيعي وجزئ الخلية المنجلية هو فقط 2 من الاحماض الامينية من اصل 600 تقريبا.
 |
-يطلق علي البنية الاخري للبروتين ( البنية الثانويه) الذي يتكون من العديد من سلاسل الببتيد. والانواع الاكثر شيوعا لهذه البنية الثانوية للبروتين هي (α-helix) و (β-pleated sheet)
ويتم تثبيت كلا النوعين بالروابط الهيدروجينية بين الاحماض الامينية عن طريق ارتباط ذرة الاكسجين الموجودة في الكربونيل (بأحد الاحماض الامينية) وذرة الهيروجين من الحمض الاميني الاخر.
-بالنسبة للتركيب اللولبي او الحلزوني فان الكربونيل (C=O) يرتبط برابطه هيدروجينية مع حمض اميني اخر عن طريق ذرة الهيدروجين (N-H) .
ويستمر هذا النمط من الترابط حتي يعطي الشكل الحلزوني او اللولبي لسلسة عديد الببتيد التي تشبه الشريط الملتوي وتحتوي كل لفه علي 3.6 من الاحماض الامينية. وتكون المجموعة الطرفية(R) للخارج بحيث يكون لها حرية التفاعل.
وتحتوي العديد من البروتينات على كل من اللوالب α والصفائح المطوية ، على الرغم من أن بعضها يحتوي على نوع واحد فقط من البنية الثانوية
 |
| الشكل الثانوي للبروتين كلولب الفا وصفائح بيتا |
*البنية الثلاثيه للبروتين:
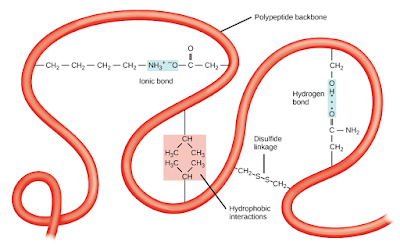
-ويسمي الهيكل ثلاثي الابعاد لعديد الببتيد بالبنية الثلاثيه ويرجع ذلك الي التفاعلات بين مجموعات الاريل(R) للاحماض الامينية التي يتكون منها البروتين .
وترتبط مجموعات (R) ببعضها بروابط هيدروجينية hydrogen bonding او روابط ايوينة
ionic bonding او عن طريق تفاعلات ثنائي القطب dipole-dipole interactions، حيث تتجاذب مجموعات (R) التي تختلف في شحناتها وتكون روابط هيدروجينية . ومن المهم ايضا لهيكلة البنية الثلاثية التفاعلات الكارهة للماء حيث تتجمع الاحماض الامينية الكارهة للماء مع مجموعات (R) غير القطبية داخل البروتين اما الاحماض الامينية المحبة للماء تكون في الخارج للتفاعل مع جزيئات الماء المحيطه .
-وهناك نوع خاص من الروابط التساهمية يمكن ان تساهم في البنية الثلاثية وهي روابط ثنائي كبريتيد
Disulfide bonds وتعتبر رابطه تساهمية قوية جدا وتكون بين السلاسل الجانبية المحتوية علي الكبريت من الحمض الأميني السيستين، وهي تعمل بمثابة دبابيس امان للجزئ كله ( للتثبيت ) مع ابقاء اجزاء من عديد الببتيد متصلة ببعضها البعض بقوة.
*البنية الرباعيه للبروتين:
تتكون هذه البينة عن طريق ارتباط سلاسل متعددة من عديد الببتيد فتتجمع هذه السلاسل في الفراغ لتعطي هذه الهيكلة للبروتين.
ومن الامثلة المعروفة لهذه البينة، الهيموجلوبين ( فان الهيموجلوبين يحمل الاكسجين في الدم ويتكون من اربع وحدات فرعية اثنان من كل من انواع الفا وبيتا)
وكذلك DNA polymerase وهو انزيم يقوم بتكوين خيوط جديدة من DNA ويتكون من عشر وحدات فرعية.
-وترتبط البنية الرباعية كذلك بروابط هيدروجينية كما هو الحال في البنية الثلاثية.
 |
- لكل بروتين شكله المميز ، فإذا تعرض البروتين لدرجة حرارة مختلفة عن بيئته او حدث تغير في ال PH الخاصه به او تعرض لمواد كيمائية فان بنيته ثلاثية الابعاد تتشوه ويفقد هيكلته ويعود الي سلسلة غير منظمة من الاحماض الامينية. ولكن يزال يحتفظ بتسلسله الاساسي وحينئذ يعتبر هذا البروتين مشوه او تم تحريفه وعادة ماتكون هذه البروتينات غير فعالة.
- بعض هذه التغيرات لحالة البروتين يمكنها مرة اخري ان تعود الي بيئتها الطبيعية وذلك لان البنية الاساسية لعديد الببتيد تزال سليمة (اي ان الاحماض الامينية لم تنقسم) حيث انها تكون قادرة علي الانثناء مرة اخري والعودة الي هيكلتها الفراغية واستعادة البروتين الي وظيفته مرة اخري.
ولكن في بعض الاحيان هذه التشوهات قد تكون دائمة اي لا يمكن اصلاحها مرة اخري ومثال علي ذلك مايتم في ( سلق البيض) وتغير حالته بحيث يصبح بروتين الالبومين في بياض البيضه صلبا ولن يعود الي حالته الاصلية مرة اخري حتي عند التبريد .
وقد وجد الباحثون ان بعض البروتينات يمكنها ان ترجع الي حالتها الطبيعية بمفردها وتعود الي شكلها الفراغي ولكن هذا يجب ان يحدث عند احتفاظ هذه البروتينات بتسلسلات الاحماض الامينية الخاصه بها واللازمة لجميع المعلومات لاعادة بنيتها مرة اخري.
ومع ذلك ليست كل البروتينات قادرة علي اعادة هيكلتها مرة اخري من تلقاء نفسها كما هو الحال في الخلية والتي تعتبر اكثر تعقيدا . تحصل بعض البروتينات علي المساعده من بروتينات (chaperonins) حتي تنثني وتعود الي حالتها مرة اخري.
ختاماً نجد أن هذا التتنظيم الفراغي للبروتين هو مفتاح لفهم وظيفته، فالبروتين لا يكون قادرا على انجاز وظائفه ما لم يكن ذو بنية ثلاثية الأبعاد أو في التشكيل الفراغي المناسب له.
للمزيد من الفهم يمكنك مشاهدة الفيديو التالي لأحد أعضاء المبادرة لفهم ما هو تركيب البروتين
https://www.youtube.com/watch?v=GQtOhEy9PbQ&list=PL4raleSvJae_2R5EBUTL2JYaWkocMxkPz&index=2
المصادر:
- Watt, Jeremy. (2010, February 1). The denatured egg white. In Moment of science. Retrieved from http://indianapublicmedia.org/amomentofscience/denatured_egg_white/.
- Egg white. (2015, July 20). Retrieved July 25, 2015 from Wikipedia: https://en.wikipedia.org/wiki/Egg_white.
- Berg, J. M., Tymoczko, J. L., and Stryer, L. (2002). Secondary structure: Polypeptide chains can fold into regular structures such as the alpha helix, the beta sheet, and turns and loops. In Biochemistry (5th ed., section 3.3). New York, NY: W. H. Freeman. Retrieved from http://www.ncbi.nlm.nih.gov/books/NBK22580/.
- Protein secondary structure. (2015, June 16). Retrieved July 25, 2015 from Wikipedia: https://en.wikipedia.org/wiki/Protein_secondary_structure.
- Marians, K. J., Hiasa, H., Kim, D. R., and McHenry, C.S. (1998). Role of the Core DNA Polymerase III Subunits at the Replication Fork. J. Biol. Chem., 273, 2452-2457. http://doi.org/10.1074/jbc.273.4.2452.
6- https://www.khanacademy.org/…/proteins-and-amino-acids/a/or…









التعليقات على الموضوع